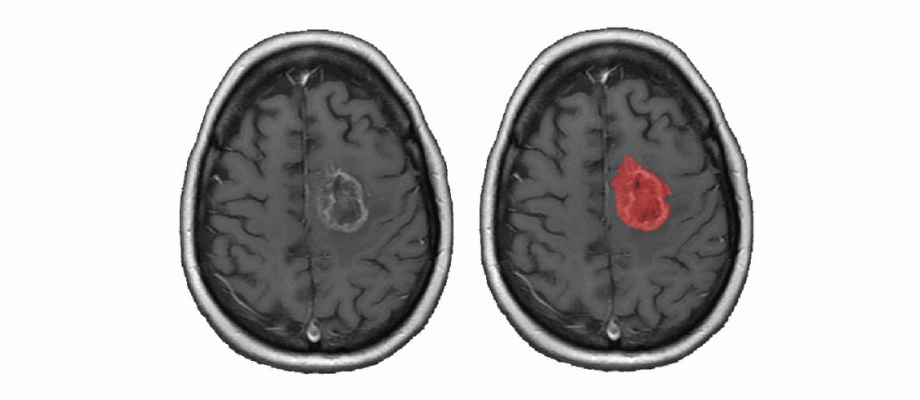
AVHANDLING. Den 7 oktober disputerar Emilia Gryska vid Institutionen för kliniska vetenskaper, inom ämnet medicinsk strålningsvetenskap. Avhandlingen undersöker vad som krävs för att nya AI-algoritmer för automatisk avgränsning av hjärntumörer i magnetkamerabilder ska kunna implementeras i kliniken.

Vid hjärntumörer används tumörens volym som ett kriterium för att bedöma allvarlighetsgraden. Men volymen mäts sällan i exakta mått, utan skattas ofta visuellt via magnetkamerabilder. Om neuroradiologerna istället använde sig av AI-algoritmer som identifierar och automatiskt avgränsar en tumör i en bild (segmentering), skulle detta kunna ge radiologerna exakta mätningar av tumörvolymen. En segmentering av tumörer ger information om tumörens läge och volym.
Klyftan mellan forskning och tillämpning
Trots att det finns många studier som utvecklar och validerar algoritmer för segmentering av hjärntumörer är det sällan möjligt att bedöma algoritmernas kliniska lämplighet, eftersom dom inte beskrivs tillräckligt detaljerat för att resultaten ska vara reproducerbara, något Emilia Gryska nu uppmärksammar i sin avhandling. Emilia har en bakgrund inom biomedicinsk teknik, och är anställd inom ämnesområdet Medicinsk strålningsvetenskap vid Göteborgs universitet.
Hon har nu undersökt klyftan mellan forskningen och kliniken med följande tre frågor:
- Ger forskningen belägg för att algoritmerna kommer att fungera väl i klinisk rutin?
- Litar radiologer på AI-genererad information och anser de att den är till hjälp?
- Vad behöver radiologer för att kunna lita på och använda verktygen?

– I mitt forskningsarbete har jag länge fokuserat på hur man kan genomföra vetenskapliga innovationer i klinisk praxis. Jag har haft ett särskilt fokus på algoritmer för artificiell intelligens inom medicinsk bildanalys.
Tillförlitlig AI-uträkning
För att lösa problemen med att oberoende forskare inte kan återskapa en algoritm, tillämpa den på samma bilder och få liknande resultat, har hon föreslagit uppdaterade riktlinjer för att utforma studier så att de kan reproduceras.
– Jag fann även att radiologer tenderar att lita mer på noggrannheten hos den AI-beräknade tumörvolymen, trots en stor variation i den upplevda segmenteringskvaliteten, än på den egna visuella bedömningen. Denna positiva inställning till AI är dock inte tillräcklig för att säkerställa att de framtida kliniska verktygen faktiskt kommer att få förtroende och användas.
Hon identifierade också flera specifika förtroenderelaterade villkor som måste uppfyllas för att framgångsrikt införa AI-verktyg inom radiologin. Verktygen och införandet av dom, måste vara tillförlitliga och transparenta i avseende hur verktyget genererar informationen och hur den ska tolkas. Dessutom måste verktyget lätt kunna implementeras i och vara kompatibelt med den kliniska verksamheten och vardagen.
– Forskningsresultaten överbryggar delvis klyftan mellan forskningen och kliniken. Men framtida forskning bör fokusera på att pröva algoritmer på ett sätt som fastställer starka bevis för segmenteringsnoggrannhet i en klinisk miljö, och hur radiologer använder den information dom får genom algoritmerna i sitt kliniska arbetsflöde.
Det är även viktigt att utveckling av AI-algoritmer ger fördelar för patienterna, som att diagnosen i detta fall kommer vara snabbare och mer exakt.
– Ett framgångsrikt genomförande av AI-verktyg som leder till förtroende för beslutsstödsystemet kräver inte bara samarbete mellan läkare och verktygsutvecklare utan även förståelse och stöttning från sjukhusledning.
AV: SUSANNE LJ WESTERGREN
INFORMATION OM DISPUTATIONEN
Tid: 7 oktober, 2022, kl 13:00 Plats: Arvid Carlsson hörsal, Academicum, Medicinaregatan 3, Göteborg.
Disputationen kan även följas digitalt.
Huvudhandledare: Rolf A. Heckemann
Bihandledare: Justin Schneiderman och Isabella Björkmann-Burtscher
Opponent: Örjan Smedby, Kungliga Tekniska Högskolan, KTH, Huddinge
Betygsnämnd: Toshima Parris, Peter Lundberg och Robin Strand